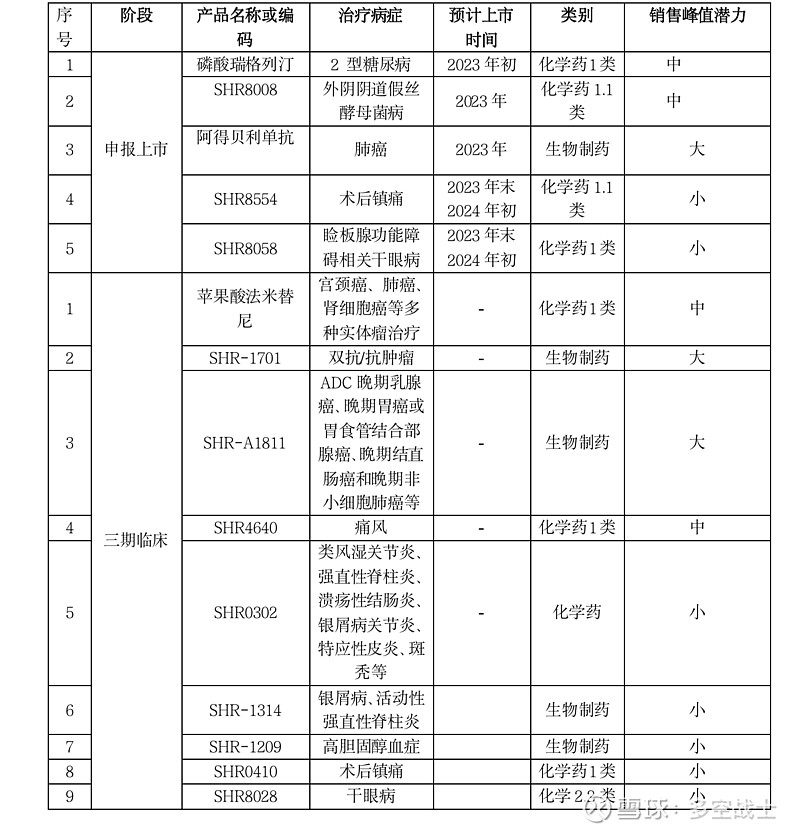
恒瑞医药的重要研发管线(二)
来源:雪球App,作者: 多空战士,(https://xueqiu.com/7548136046/243182240)
一、已报产创新药:
(一) 磷酸瑞格列汀
适应症为DPP-Ⅳ抑制剂/2 型糖尿病。2021年7月启动上市申请,2023年初将审批完成。磷酸瑞格列汀是公司自主研发的化药1 类新药口服类降糖药,为二肽基肽酶Ⅳ(DPP-Ⅳ)抑制剂,获得国家十二五“重大新药创制”科技专项。这种新药实际是在默克公司一种专利药叫西格列汀基础上进一步开发而来的。
糖尿病可分为1型糖尿病、2型糖尿病等,其中2型糖尿病患者占90%以上。WHO统计结果显示,目前全球已诊断的2型糖尿病达1.3亿人,我国已超过4000万人,是继印度之后的第二大糖尿病大国。
国内处于临床三期的还有 信立泰 的苯甲酸复格列汀片、 石药集团 的DBPR108胶囊、 海思科 的HSK7653片、盛世泰科的磷酸盛格列汀。另外正大天晴、 天士力 等几家企业开展了临床研究。可见,DPP-4抑制剂在研新药竞品较多,将面临激烈的市场竞争。
(二)SHR8008
CYP51 酶抑制剂/外阴阴道假丝酵母菌病。SHR8008胶囊的药品正在上市申请,是一种用于治疗急性外阴阴道假丝酵母菌病的新型口服唑类抗真菌药物,可高度特异性抑制真菌CYP51酶。是1类创新化药,相关项目累计已投入研发费用约9,124万元。
SHR8008是美国Mycovia公司开发的一种新型口服唑类抗真菌药物,可高度特异性抑制真菌CYP51酶。2019年6月, 恒瑞医药 与Mycovia公司达成超1亿美元的(license in)合作,获得了该药在大中华区的独家权益。值得注意的是,该产品已于今年4月获得美国FDA批准,用于在不具有生殖潜力的女性中,降低复发性外阴阴道假丝酵母菌病(RVVC)的复发几率。
恒瑞获得在许可区域,即中华人民共和国(包括中国大陆、香港、澳门和台湾)的临床开发、注册、生产和市场销售的独家权益。许可的适应症为所有人类和动物疾病和症状的治疗和预防,包括但不限于复发性外阴阴道念珠菌病、甲真菌病和侵袭性真菌感染。
此次交易涉及的金额为:(1)研发付款:恒瑞将向 Mycovia 支付共计 750 万美元的研发付款。该款项将在两年内、按季度、分八次平均支付,用于支持 Mycovia 正在进行的临床研究。
(2)研发及上市里程碑付款:从 VT-1161 在中国的第一项注册临床研究开始至第一个适应症在中国获批上市,恒瑞将按研发进展向 Mycovia 支付累计不超过 900 万美元的里程碑款。
(3)销售里程碑付款:从 VT-1161 在中国开始商业销售开始,恒瑞将根据实际年净销售额向Mycovia 支付累计不超过 9,200 万美元的里程碑款。
上述三项合计约为1.08亿美元。此外,开始销售后,还需支付提成。
(4)销售提成:从 VT-1161 在中国开始商业销售开始,恒瑞将按照约定比例,根据实际年净销售额向 Mycovia 支付销售提成。年净销售额的提成比例区间为 7%至 11%,随年净销售额的增加而梯度性增加。
外阴阴道念珠菌病(VVC)是由念珠菌感染引起的外阴阴道炎症,是最常见的女性外阴阴道炎症之一。研究估计约 75%的女性在一生中至少会感染一次 VVC。这些女性中约有一半人会经历反复感染,其中 5~9%会发生 RVVC。RVVC 通常被定义为在 12 个月内至少出现 3 次或 4 次 VVC(不同文献和指南对次数的要求略有不同)。据《柳叶刀-感染性疾病》杂志于2018 年报道的 RVVC 全球流行病学系统回顾研究估算,中国约有 2900 万 RVVC 患者。
此外,VT-1161 其它开发中的适应症包括侵袭性真菌感染和甲真菌病。目前暂无其他四氮唑类抗真菌药物处于临床阶段。国内现有已上市的抗真菌唑类药品包括氟康唑、伏立康唑等,但前述疾病仍然需要更加有效、安全的疗法。根据 艾昆纬 数据,氟康唑和伏立康唑在中国市场 2018 年的年销售额分别约为 6.4 亿元和 24.2 亿元。
此药值得重点关注,国内竞争较小,有望冲击10亿以上大单品。
(三)阿得贝利单抗
适应症为PD-L1 单抗/肺癌。阿得贝利单抗(SHR-1316)是公司自主研发的一种人源化抗 PD-L1 单克隆抗体生物制药,主要用于恶性肿瘤的治疗。阿得贝利单抗作为 PD-L1 单抗药物,可以解除 PD-L1 介导的免疫抑制效应,增强杀伤性 T 细胞的功能,发挥调动机体免疫系统清除体内肿瘤细胞的作用。
2022 年 1 月广泛期小细胞肺癌适应症申报上市,预计2023年获批上市。其它适应症包括小细胞肺癌以及非小细胞肺癌等均处于Ⅲ期临床研发阶段。
广泛期小细胞肺癌属于难治性、高侵袭性的肺癌亚型,且患者治疗选择有限。依托泊苷联合铂类化疗是目前我国一线治疗的标准方案之一,但化疗的生存获益有限,患者中位总生存期(OS)小于1年,5年生存率仅为1%~2%。CAPSTONE-1研究结果显示,阿得贝利单抗联合化疗一线治疗广泛期小细胞肺癌,中位总生存期(OS)达15.3个月(vs 化疗12.8个月),2年生存率达31.3%(vs化疗 17.2%),中位无疾病进展期(PFS)达5.8个月,相较于化疗组显著降低患者疾病进展风险达33%。在试验中,阿得贝利单抗联合化疗的安全性与之前同类临床试验一致,与对照组安慰剂联合化疗相比患者≥3级治疗相关不良事件发生率相当。
2021年思路康瑞的恩沃利单抗和 基石药业 的舒格利单抗获批,分别拿下了国产PD-L1单抗的第一和第二。兆科药业的首克注利单抗和 科伦药业 的泰特利单抗也已提交了NDA,2023年1 月 13 日,
正大天晴 PD-L1 单抗 TQB2450 注射液申报上市.
加上有4家进口PD-1/PD-L1在中国上市销售,市场竞争空前激烈。阿得贝利单抗注射液相关项目累计已投入研发费用约 2.7亿元。作为恒瑞又一款me too类创新药,借助恒瑞的销售优势,预计很快能拓展较多市场份额。更多地看点是阿得贝利单抗可以开展更多适应症,有望成为公司另一重磅单品。
(四)SHR8554
适应症MOR 激动剂/术后镇痛。是由公司自主研发的创新药,注册分类为化学药品第 1 类。2022 年 7 月腹部术后镇痛适应症申报上市,预计2023年末2024年初上市。同时骨科术后镇痛二期临床研究进行中。
SHR8554 是偏向性的 MOR 激动剂,可以选择性地激活 G 蛋白偶联通路,而对于 β-arrestin-2 通路仅有很弱的激活作用。这样的选择性作用保证了 SHR8554 具有中枢镇痛效果的同时,可减轻胃肠道不良反应和减少呼吸抑制不良反应的发生率。目前国内暂无镇痛作用良好、不良反应发生率低的偏向型MOR激动剂上市,临床需求未被满足,如果 恒瑞医药 的SHR8554上市,将填补这一空白。 海思科 的HSK16149胶囊则是一种电压门控钙离子通道类新型镇痛药,属于普瑞巴林的me-better药物,具备高靶点选择性、强效镇痛、长效镇痛、中枢副作用小等特点,对中至重度患者疗效可能更佳。两款1类新药均瞄准止痛药市场,且申报上市的时间差在3个月左右。目前两者均未上市。上市后25年销售可达3-4亿。
(五)SHR8058
全氟己基辛烷/睑板腺功能障碍相关干眼病。已完成Ⅲ期临床研究,上市许可申请获国家药监局受理。主要研究终点结果达到方案预设的优效标准。SHR8058滴眼液是一种澄清透明、无色、无颗粒、几乎无气味的无菌眼药水。SHR8058滴眼液活性成分单一,为全氟己基辛烷,它不含油脂、表面活性剂和防腐剂等赋形剂。 预计2023年末2024年初上市。
SHR8058 是由公司 license in 的一种单一组分全氟己基辛烷(F6H8)的无菌滴眼液,是基于全球首个无水药物递送技术平台 EyeSol®开发的药物之一。 SHR8058 具有双效作用机制:一方面,由于其极低的表面张力,SHR8058 可迅速扩散至眼表面,其亲脂集团与泪膜脂质层形成 长效持久的相互作用,在泪膜空气界面处形成保护层,稳定泪膜,防止泪液过度蒸发;另一方面,SHR8058 滴眼液可穿透睑板 腺,与腺体相互作用并溶解腺体中的粘性分泌物,促进睑板腺分泌睑酯功能恢复。
二、以下为三期临床重要研发产品:
(一)苹果酸法米替尼
苹果酸法米替尼是公司自主研发的全新小分子多靶点酪氨酸激酶抑制剂。苹果酸法米替尼正在开发的适应症包括联合卡瑞利珠治疗宫颈癌、肺癌、肾细胞癌等多种实体瘤治疗。其中,联合卡瑞利珠单抗治疗宫颈癌被 CDE 纳入突破性治疗。目前处于III期临床阶段。
2021年8月,注射用卡瑞利珠单抗联合苹果酸法米替尼胶囊用于晚期非小细胞肺癌III期临床试验的函。
国内外有索拉非尼、舒尼替尼、培唑帕尼等多种同类产品获批上市。索拉非尼由拜耳公司开发,于2005年在美国获批上市;舒尼替尼由辉瑞公司开发,于2006年在 美国获批上市;培唑帕尼由诺华研发,于2009年在美国获批上市,三款多靶点抑 制剂均已在国内获批上市。经查询EvaluatePharma数据库,索拉非尼、舒尼替尼、培唑帕尼的2021年全球销售额约为17.65亿美元。截至目前,苹果酸法米替尼相关项目累计已投入研发费用约为20,077万元。其主要用途是与卡瑞利珠联合用药。
(二)SHR-1701
PD-L1&TGF-β 双抗/抗肿瘤生物制药。已开展针对晚期结直肠癌、非小细胞肺癌、胃癌等多种实体瘤的Ⅲ期临床研究,研发投入达到3.5亿。预计上市时间在2024、2025年。
SHR-1701 是公司自主研发的靶向 PD-L1 和 TGF-β 双靶点的双特异性抗体。TGF-β 除了可以促进肿瘤细胞的迁移、浸润,进而促进癌症的进展和转移之外,还能进一步上调抗原递呈细胞(APC)上的 PD-L1,而 APC 细胞可以释放可溶性的 PD-L1 到肿瘤微环境中,通过 PD-L1 与其受体的相互作用直接抑制细胞毒性 T 淋巴细胞。因此,在抑制 PD-1/PD-L1 通路的基础上,靶向中和肿瘤微环境中的 TGF-β 可以进一步使 T 细胞恢复活性,增强免疫应答。
SHR-1701注射液已在中国开展多项实体瘤临床试验,包括SHR-1701单药或联合贝伐珠单抗注射液、苹果酸法米替尼等治疗鼻咽癌、宫颈癌、非鳞非小细胞肺癌、晚期结直肠癌等多个瘤种的临床试验,并在澳洲开展I期临床试验。
随着创新药进入下半场,以 恒瑞医药 为代表的传统药企,需要一个甚至几个拳头产品来为自己的转型正名。从 恒瑞医药 管线来看,SHR-1701是当前最有可能证明自身“创新”能力的产品之一。虽然默克的M7824出师不利,但从另一个角度来看,目前这一市场尚未有踏足者,那么对药企来说,也许是一个实现弯道超车的好机会。
目前,国内外尚无同类产品获批上市。上市后有望超越卡瑞丽珠单抗的大单品,峰值可超过30亿。
但关于此药,市场争议不小,不只是针对 恒瑞医药 ,主要是针对这两个靶点的双抗药物。对此,有说研发成功率不高的,有说这类双抗其实和PD-1单药治疗差距不大的。
(三)SHR-A1811
是 恒瑞医药 自主研发的、以HER2为靶点的抗体药物偶联物(ADC)。可通过与HER2表达的肿瘤细胞结合并内吞,在肿瘤细胞溶酶体内通过蛋白酶剪切释放毒素,诱导细胞周期阻滞从而诱导肿瘤细胞凋亡。目前已开展多项I-III期临床研究,涵盖HER2表达或突变的晚期实体瘤包括晚期乳腺癌、晚期胃癌或胃食管结合部腺癌、晚期结直肠癌和晚期非小细胞肺癌等。HER2 阳性转移性乳腺癌已开展Ⅲ期临床。
2023年2月,SHR-A1811被国家药品监督管理局药品审评中心拟纳入突破性治疗品种公示名单,用于人表皮生长因子受体2(HER2)阳性的复发或转移性乳腺癌患者;用于人表皮生长因子受体2(HER2)低表达的复发或转移性乳腺癌患者,同一天获得2个拟纳入突破性疗法认定。
什么是突破性疗法认定?
为鼓励研究和创制具有明显临床优势的药物,国家药品监督管理局药品审评中心(CDE)发布了《国家药监局关于发布<突破性治疗药物审评工作程序(试行)>等三个文件的公告》(2020年第82号),明确了突破性疗法的纳入范围:药物临床试验期间,用于防治严重危及生命或者严重影响生存质量的疾病且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等。药审中心对纳入突破性治疗药物程序的药物优先配置资源进行沟通交流,加强指导并促进药物研发。
经查询,目前国外已上市的同类产品有Kadcyla®(T-DM1)和Enhertu®(DS-8201a)。Kadcyla®由罗氏公司开发,2019年国内已进口上市。Enhertu®由 阿斯利康 和第一三共共同开发。国内外另有ARX788、DP303c、A166、RC48、SYD985、BAT8001等多款产品处于临床试验阶段。经查询Evaluatepharma数据库,Kadcyla®和Enhertu®的2019年销售总额约为14.31亿美元。预计上市时间在2025年以后,上市后有望超越卡瑞丽珠单抗的大单品,峰值可超过30亿。
(四)SHR4640
适应症是URAT1 抑制剂/痛风。是公司自主研发的国内首个高选择性的强效尿酸重吸收转运子 1(Uric Acid Reabsorption Transporter 1,URAT1) 抑制剂,能够高度选择性、高活性地抑制 URAT1,促进尿酸的排泄,从而用于治疗痛风和高尿酸血症,且与黄嘌呤氧化酶抑制 剂非布司他等药物联用疗效更佳。以往的体外和体内试验中均已显示了 SHR4640 显著的降尿酸作用和良好的安全性。目前正在国内进行三期临床。
公司是国内唯一布局URAT1靶点的企业,有望抢占国内空白市场。根据ClinicalTrial数据显示,目前进展较快的为恒瑞的SHR-4640,正在国内与美国同步开展痛风适应症的3期临床试验;高尿酸血症在美国的2期临床已完成,在国内正在进行3期临床。 恒瑞医药 于上半年一直在加速度推进3期临床,发布多次临床招募。据《中国药物应用与监测》统计,国内高尿酸血症患病率约10%,约有1.3亿的潜在人群,国内痛风患病率约1%~3%,患者约有1700万人,并呈逐年上升趋势,已成为我国第二大代谢类疾病。我国痛风市场规模增长迅速,2016年销售额就已超过亿元,且保持快速增长。
多家研报预测SHR-4640销售峰值可达21.6亿元。估算SHR-4640销售峰值可达20亿元。
(五) SHR0302
适应症为:JAK1 抑制剂/类风湿关节炎、强直性脊柱炎、溃疡性结肠炎、银屑病关节炎、特应性皮炎、斑秃等 。目前是Ⅲ期临床,同时美国Ⅲ期、欧洲Ⅲ期。
SHR0302 片是公司自主研发的以 JAK1 为作用靶点的 JAK 抑制剂,能针对性阻断 JAK/STAT 通路,在得到良好的临床疗效的基础上,可减少不良反应,如贫血、血栓性疾病,且作为口服小分子靶向药物,便捷的给药方式可显著提高患者的治疗依从性。特应性皮炎适应症已被纳入突破性治疗。
恒瑞在JAK抑制剂开发上,尤其是新拓展适应症如斑秃、白癜风、特应性皮炎等适应症上,将fast-follow发挥到了极致。
多家机构研报测算:SHR0302的销售峰值可达10亿元。
(六)SHR-1314
适应症为:IL-17 单抗/银屑病、活动性强直性脊柱炎等。Ⅲ期临床(国际多中心Ⅱ期)
SHR-1314 是公司自主研发的人源化的 IgG1 抗 IL-17A 单克隆抗体药物,与 IL-17A 结合后抑制下游细胞因子,阻断炎症信号传导。
SHR-1314 已在成人中重度慢性斑块型银屑病、成人强直性脊柱炎Ⅲ期临床研究中证实可缓解疾病进展且安全性耐受性良好。 此外,还在成人活动性银屑病关节炎、成人活动性中重度甲状腺相关眼病等多种自身免疫性疾病中开展Ⅱ期临床试验研究。
目前国外已上市的IL-17抗体有3个,分别为Cosentyx(secukinumab)、Taltz(ixekizumab)和Siliq(brodalumab)。Cosentyx由 $诺华制药(NVS)$ 开发,于2015年1月获得EMA批准,是全球首个上市的IL-17抑制剂。Taltz由 $礼来(LLY)$ 开发,于2016年3月获FDA批准。Siliq最初由 安进 (Amgen)研发,几经转手,2016年Valeant公司授权给Leo制药,2017年FDA批准其上市。其中,诺华的secukinumab(司库奇尤单抗注射液)已于2018年9月在国内获批上市, 礼来 的ixekizumab的国内上市申请正在审评中。全球市场仍有较大空间,已上市产品快速放量。Cosentyx占据首发优势,上市首年销售额即达到约3亿美元,2018年销售额打到28.37亿美元,同比增长37%,仍在快速放量中。Taltz市场份额虽然不如first-in-class品种,但2018年销售额也达到9.38亿美元,同比增长68%,增长势头依然迅猛。据IMS数据估计,2019年全球抗银屑病药物市场规模将超过百亿美元,全球IL-17单抗市场仍有较大空间。
估计SHR-1314的销售峰值约为5.5亿元。
(七)SHR-1209
PCSK9 单抗/高胆固醇血症。三期临床。SHR-1209 是公司自主研发的抗 PCSK9 单抗,拟用于治疗高胆固醇血症。通过特异性结合 PCSK9 分子,减少 PCSK9 介导的细胞
表面低密度脂蛋白受体内吞,从而降低低密度脂蛋白胆固醇(LDL-C)水平。 SHR-1209 特点是可以进行较长间隔给药,有望为高胆固醇血症患者提供比现有治疗方案更多的获益。
截至目前,全球已经批准3款PCSK9靶向药。其中 安进 的依洛尤单抗(商品名:瑞百安)和赛诺菲/再生元的阿利西尤单抗(商品名:波立达)已先后在国内获批,且均通过2021年医保谈判进入国家医保。
估计 SHR-1209 的销售峰值约为5亿元。
(八)SHR0410
KOR 激动剂/术后镇痛。Ⅲ期临床。
SHR0410 是由公司自主研发的创新药,注册分类为化学药品第 1 类,对外周 KOR 具有高度选择性,对其他阿片受体的亲和力极弱。外周选择性 KOR 激动剂可通过降低外周的游离神经末梢的兴奋性、抑制神经递质的释放抑制疼痛和瘙痒。
(九) SHR8028
环孢素 A/干眼病 。化学2.2类新药,正在Ⅲ期临床。SHR8028 是由公司 license in 的一种透明的环孢素 A 眼用溶液,是基于全球首个无水药物递送技术平台 EyeSol®开发的药物之一。使用半氟化烷烃的全氟丁基戊烷(F4H5)作为溶剂,能够增加环孢素 A 在 SHR8028 滴眼液中的溶解。 SHR8028 不含油、表面活性剂和防腐剂,潜在优势包括局部生物利用度高、起效快、局部耐受性好等显著优点,减少油性眼药水、乳剂或软膏相关的视觉干扰。
三、总结见下表: